

Lorem ipsum dolor sit amet, consectetur adipiscing elit
Acompanhe
O Exame Nacional do Ensino Médio (Enem) é marcado por duas provas de conhecimentos gerais e distintos entre as datas.
No segundo dia, a prova de Ciências da Natureza e suas Tecnologias é realizada em conjunto com a de matemática, sendo abordadas as disciplinas de biologia, física e química.
Estas matérias costumam aparecer de forma interdisciplinar nas questões apresentadas no exame, o que necessita de um estudo e conhecimento aprofundado.
Dentro da física cobrada no Enem, os conteúdos que mais caem na prova são:
Para muitos estudantes, entre todas estas disciplinas, a termodinâmica é a mais complicada de garantir uma boa nota, pois exige um domínio maior devido às suas leis. Assim, é a que mais precisa de estudo e cuidado.
Você vai aprender sobre as Leis da Termodinâmica a seguir. Confira:
A termodinâmica surgiu através da criação das máquinas térmicas movidas a combustível fóssil. A partir disso, a sua ciência foi sendo estudada para analisar os processos de troca de calor, observando as variações da temperatura, da pressão e do volume e como elas interferem nos sistemas físicos.
Para descrever suas propriedades foi necessário elaborar leis que definam suas grandezas físicas como a temperatura, entropia e trabalho.
Além disso, os conceitos de sistema termodinâmico, estado de sistema e processo são fundamentais na hora de entender o conteúdo de forma completa.
As leis consistem em Lei Zero, Primeira Lei, Segunda Lei e Terceira Lei.
🔵 Leia também: Os assuntos de Física que mais caem no Enem
A Lei Zero da Termodinâmica aborda sobre as condições que dois corpos precisam para chegar ao equilíbrio térmico.
Essa lei afirma que se A e B estão separadamente em equilíbrio com um terceiro corpo, consequentemente, estarão em equilíbrio térmico entre si.
Então se A está em equilíbrio térmico com B e A está em equilíbrio térmico com C, logo B está em equilíbrio térmico com C, mesmo não estando em contato.
Isto explica que quando dois corpos com temperaturas diferentes entram em contato, o corpo mais quente tende a transferir calor para o corpo mais frio para que as temperaturas se igualem e cheguem ao equilíbrio térmico.
Imagine que você irá beber uma xícara de café quente mas na pressa para esfria-lo, despeja leite na bebida para não se queimar. O café com leite, cuja temperatura é distinta, chegou ao equilíbrio térmico.
A escala de temperatura permitida pela Lei Zero é medida em Celsius, Fahrenheit, Kelvin, Réaumur, Rankine, Newton e Leiden.
Saiba também que a temperatura é influenciada pela condutividade térmica , seja maior ou menor em materiais diferentes.
🔵 Leia também: Lei de Arquimedes: como o assunto é cobrado no Enem
A Primeira Lei da Termodinâmica estabelece o princípio da conservação de energia e trata da relação entre calor, trabalho e energia interna.
Isto é, em um processo termodinâmico, toda a energia que é transferida para um corpo é conservada e se transforma em energia interna, pois a energia não pode ser criada e nem destruída, apenas transformada.
Para a aplicação desta lei se faz o uso da variação de energia interna (ΔU), que é medida pela diferença entre o calor por ele trocado (Q) e a quantidade de trabalho realizado sobre ou por ele (W).
A fórmula que a define é ΔU = Q − W.
O seu uso pode ser exemplificado por uma bomba para encher um objeto inflável. Quando o ar está sendo colocado para dentro, uma força é utilizada, então a energia cinética faz o pistão abaixar, se tornando calor.
🔵 Leia também: Veja como usar a nota do Enem para entrar na faculdade
A segunda lei da Termodinâmica diz respeito a uma grandeza física conhecida como entropia, a medida do número de estados termodinâmicos de um sistema que fornece aleatoriedade ou desorganização a um sistema.
Isso impossibilita o calor fluir de um corpo frio para um corpo quente, a não ser que haja trabalho. Entenda que em um sistema, nem todo o calor se transforma em trabalho e uma parte é perdida.
Portanto, a lei define que a energia cinética pode ser transformada integralmente em energia térmica.
Também de acordo com a lei, em um sistema fechado, a entropia nunca diminui. Pelo contrário, ela tende a aumentar até alcançar um limite máximo.
🔵 Leia também: Opções de faculdade: áreas, cursos e modalidades
A Terceira Lei da Termodinâmica diz respeito ao limite inferior da temperatura: o zer o. De acordo com essa lei, não há como um corpo atingir a temperatura do zero absoluto . Ela surge como uma tentativa de estabelecer um ponto de referência absoluto que determine a entropia.
O zero absoluto também é chamado de zero kelvin. Ele corresponde à temperatura de -273,15 °C ou -459.67 °F.
Conclui–se que não é possível que uma substância pura com temperatura zero seja a entropia num valor aproximado a zero.
É a condição em que o sistema não apresenta tendência para uma mudança espontânea de estado termodinâmico, então o sistema só mudará seu estado se sofrer alguma influência. Este equilíbrio se apresenta quando dois corpos ou substâncias atingem a mesma temperatura.
Nesse processo, o corpo mais quente transfere calor para o corpo mais frio até que ambos tenham a mesma temperatura.
Para calcular utiliza-se a fórmula Q = m.c.Δθ.
Q é a quantidade de calor sensível, M a massa do corpo, C o calor específico da substância e Δθ a variação de temperatura.
Um sistema termodinâmico é uma parte do universo físico com um limite específico para observação, que pode ser definido por paredes reais ou imaginárias. Dentro da termodinâmica , existem os seguintes tipos de sistemas:
Os gases podem constituir moléculas (CO², CO) ou se apresentarem como átomos isolados (gases nobres - He, Ne, Ar e etc). Quanto às características físicas, eles podem se expandir ou sofrer compressão, dependendo do local onde estiverem.
Esse grau de liberdade das moléculas gasosas faz com que elas se movimentem de forma desordenada, mas ao mesmo tempo contínua.
Se, por exemplo, um gás estiver em local fechado, suas moléculas em movimento passam a exercer certa força sobre as paredes internas na tentativa de escaparem, é o que chamamos de pressão.
Dentro da Termodinâmica é estudado a troca de matéria e a troca de energia pelo trabalho e pelo calor entre sistemas.
No mesmo contexto, o gás ideal é o modelo no qual as propriedades de qualquer estado de equilíbrio de um gás estão relacionadas pela equação de estado de Clapeyron:
PV = nRT
P significa a pressão, V o volume, N o número de mols, R a Constante Universal dos Gases, e T, a temperatura Kelvin do gás.
Então, o gás ideal é aquele em que as colisões entre as partículas são perfeitamente elásticas.
De acordo com a teoria cinética dos gases , o estado termodinâmico de um gás ideal é completamente descrito pelas variáveis de pressão , volume e temperatura .
Agora que você já entende o essencial das Leis de Termodinâmica, chegou a hora de praticar. Não se esqueça de voltar ao conteúdo se surgir dúvidas.
As questões abaixo foram retiradas do banco de provas e gabaritos do Enem do Instituto Nacional de Estudos e Pesquisas Educacionais Anísio Teixeira (Inep).
A invenção da geladeira proporcionou uma revolução no aproveitamento dos alimentos, ao permitir que fossem armazenados e transportados por longos períodos. A figura apresentada ilustra o processo cíclico de funcionamento de uma geladeira, em que um gás no interior de uma tubulação é forçado a circular entre o congelador e a parte externa da geladeira. É por meio dos processos de compressão, que ocorre na parte externa, e de expansão, que ocorre na parte interna, que o gás proporciona a troca de calor entre o interior e o exterior da geladeira.
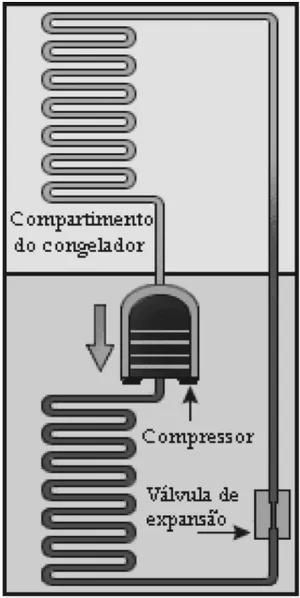
Nos processos de transformação de energia envolvidos no funcionamento da geladeira:
A) a expansão do gás é um processo que cede a energia necessária ao resfriamento da parte interna da geladeira.
B) o calor flui de forma não espontânea da parte mais fria, no interior, para a mais quente, no exterior da geladeira.
C) a quantidade de calor cedida ao meio externo é igual ao calor retirado da geladeira.
D) a eficiência é tanto maior quanto menos isolado termicamente do ambiente externo para o seu compartimento interno.
E) a energia retirada do interior pode ser devolvida à geladeira abrindo-se a sua porta, o que reduz seu consumo de energia.
✅ Resolução: Alternativa B.
Quando colocamos em contato dois corpos com temperaturas diferentes, a tendência é de que o calor transfere-se naturalmente do corpo mais quente para o corpo mais frio. Porém, para que uma geladeira funcione, deve ocorrer o processo contrário: o calor deve fluir de seu interior para seu exterior, ou seja, fluir de um local frio para um local quente. Esse processo não ocorre de forma espontânea. Na geladeira, essa é a função do compressor.
Um motor só poderá realizar trabalho se receber uma quantidade de energia de outro sistema. No caso, a energia armazenada no combustível é, em parte, liberada durante a combustão para que o aparelho possa funcionar. Quando o motor funciona, parte da energia convertida ou transformada na combustão não pode ser utilizada para a realização de trabalho. Isso quer dizer que há vazamento da energia em outra forma.
CARVALHO, A. X. Z. Física Térmica. Belo Horizonte: Pax, 2009 (adaptado).
De acordo com o texto, as transformações de energia que ocorrem durante o funcionamento do motor são decorrentes da:
A) liberação de calor dentro do motor ser impossível.
B) realização de trabalho pelo motor ser incontrolável.
C) conversão integral de calor em trabalho ser impossível.
D) transformação de energia térmica em cinética ser impossível.
E) utilização de energia potencial do combustível ser incontrolável.
✅ Resolução: Alternativa C.
Em uma máquina térmica, como o motor de combustão interna, é impossível a conversão integral de calor em trabalho, pois, no processo de conversão de energia, ocorrem perdas, que podem ser oriundas, por exemplo, do atrito entre as peças do motor por falta de lubrificação ou de perdas de calor por radiação e convecção para o meio externo.
Na montagem de uma cozinha para um restaurante, a escolha do material correto para as panelas é importante, pois a panela que conduz mais calor é capaz de cozinhar os alimentos mais rapidamente e, com isso, há economia de gás. A taxa de condução do calor depende da condutividade k do material da sua área A, da diferença de temperatura  T e da espessura d do material, sendo dada pela relação
T e da espessura d do material, sendo dada pela relação 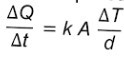 . Em panelas com dois materiais, a taxa de condução é dada por
, em que
. Em panelas com dois materiais, a taxa de condução é dada por
, em que 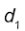 e
e 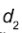 são as espessuras dos dois materiais,
são as espessuras dos dois materiais, 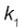 e
e 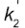 são as condutividades de cada material. Os materiais mais comuns no mercado para panelas são o alumínio (k = 20 W/m K), o ferro (k = 8 W/m K) e ao aço (k = 5 W/m K) combinado com o cobre (k = 40 W/m K).
são as condutividades de cada material. Os materiais mais comuns no mercado para panelas são o alumínio (k = 20 W/m K), o ferro (k = 8 W/m K) e ao aço (k = 5 W/m K) combinado com o cobre (k = 40 W/m K).
Compara-se uma panela de ferro, uma de alumínio e uma composta de
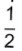 da espessura em cobre e
da espessura em cobre e 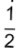 da espessura em aço, todas com a mesma espessura total e com a mesma área de fundo.
da espessura em aço, todas com a mesma espessura total e com a mesma área de fundo.
A ordem crescente da mais econômica para a menos econômica é:
✅ Resolução: Alternativa B.
Quando falamos em ordem crescente de economia de energia, devemos ordenar a opção com maior taxa de condução de calor.
Analisando cada um dos três casos:
Caso 1: Panela de Ferro
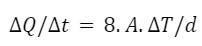
Caso 2: Panela de Alumínio
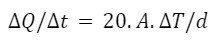
Caso 3: Panela metade Cobre e metade Aço.
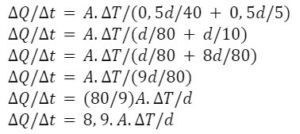
Na ordem, ficamos com: Alumínio, Cobre-Aço, Ferro.
Por Redação Blog do EAD
Gostou deste conteúdo? Compartilhe com seus amigos!

2025 © BLOG DO EAD | Todos os Direitos Reservados
Explore carreiras, mercado de trabalho e cursos de graduação no Blog do EAD. Descubra oportunidades de aprendizado e dicas para seu desenvolvimento pessoal e profissional.
2024 © BLOG DO EAD | Todos os Direitos Reservados