

Lorem ipsum dolor sit amet, consectetur adipiscing elit
Acompanhe
Estava procurando um resumo de eletroquímica bem completo? Continue conosco neste conteúdo!
Como a eletroquímica é um dos assuntos mais recorrentes na prova de Química do Enem , os estudantes devem aumentar a atenção nesse tema durante os estudos.
Pensando nisso, reunimos neste resumo de eletroquímica os principais conceitos e aplicações da área. Continue a leitura e fique por dentro do assunto!
Aqui você vai conferir:
A eletroquímica é uma das vertentes da Físico-Química. Ela é responsável pelo estudo das reações envolvidas nos processos de transferência de elétrons (as reações de oxirredução) e de transformação de energia química em energia elétrica — e vice-versa.
Desse modo, o ramo estuda tanto as reações químicas naturais como as reações provocadas pelo uso de corrente elétrica.
Os estudos da eletroquímica envolvem uma série de conceitos. O entendimento desses termos é fundamental para compreender de forma plena o conteúdo. Abaixo, apresentamos e explicamos mais sobre os principais:
As células eletroquímicas são estruturas capazes de produzir energia elétrica através da energia química. Devido a sua capacidade de produção energética, esses materiais estão presentes em células de combustível e baterias.
São substâncias capazes de conduzir eletricidade. Eles são classificados em dois tipos:
Na eletroquímica, há dois conceitos de energia bastante importantes:
❗Importante: como a energia química está sempre presente em determinadas substâncias de forma natural, esta também é conhecida como energia potencial.
Além disso, é através do deslocamento das cargas elétricas que são geradas as correntes e, consequentemente, a eletricidade utilizada por nós diariamente para alimentar nossos aparelhos eletrônicos.
São processos provocados pela passagem de corrente, que se iniciam na transferência de elétrons entre suas substâncias.
Além disso, as transformações que envolvem apenas a passagem de corrente também são chamadas de reações eletroquímicas.
A transferência de elétrons de uma substância para a outra é um dos principais processos estudados pela eletroquímica, que recebe o nome de reação de oxirredução.
Como durante essas reações um modelo atômico perde elétron e outro ganha, o processo é dividido em duas etapas:
Por exemplo, em uma reação de oxirredução entre o ferro e o cloro, teríamos a oxidação do ferro (que perdeu elétrons) e, consequentemente, a redução do cloro (que ganhou elétrons).
🔵 Leia também:
Veja como acessar a Página do Participante do Enem
A energia fornecida pelas pilhas e baterias é gerada através de reações químicas de oxirredução espontâneas, cuja energia química produzida é transformada em elétrica e consumida pelos aparelhos.
Ainda que funcionem devido ao mesmo princípio, as pilhas e baterias são materiais diferentes, dado que a primeira possui apenas dois eletrodos, enquanto as baterias são compostas de várias pilhas conectadas em série ou paralelo — possuindo vários eletrodos.
Dessa forma, a capacidade elétrica das baterias é superior.
Em relação às pilhas, estas são compostas de substâncias químicas capazes de realizar a transferência espontânea de elétrons. Além disso, o material possui dois eletrodos chamados de:
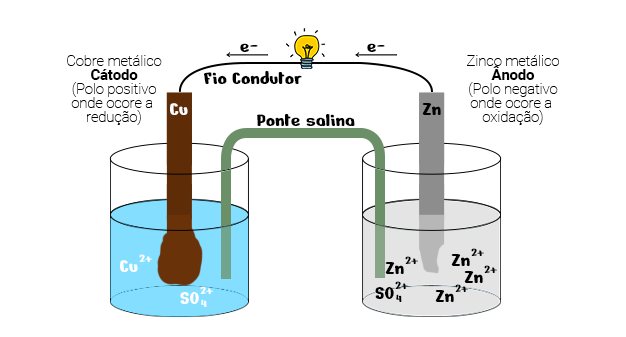
Criada em 1836 por John Frederic Daniell , a Pilha de Daniell era formada por dois eletrodos metálicos conectados por um fio.
Para representar o catodo, o químico utilizou uma placa de cobre metálico (Cu), imerso em uma solução de sulfato de cobre (CuSO 4 ).
Já o ânodo, foi representado por uma placa de zinco metálico, imerso em uma solução aquosa de sulfato de zinco (ZnSO 4 ).
Além disso, o sistema era composto por duas semi células unidas por uma ponte de salina, cujo objetivo era manter a neutralidade elétrica das soluções e provocar o deslocamento dos ânions para o lado com excesso de carga positiva e dos cátions para o lado com excesso de carga negativa.
A eletrólise é um processo considerado inverso àquele que ocorre nas pilhas e baterias, dado que suas reações não são espontâneas e transformam energia elétrica em química — enquanto nas pilhas o resultado é o oposto.
A eletrólise pode ocorrer de duas formas:
As melhores formas de estudar esse conteúdo para o Enem são:
A segunda estratégia possui alta eficiência, pois ajuda o estudante a retirar o assunto do campo meramente teórico e abstrato e colocá-lo em sua realidade — é como se transformasse um desenho imaginário em algo real.
Sem falar que descobrir essas aplicações torna o assunto e os estudos mais divertidos!
Por isso, trouxemos abaixo alguns exemplos de como a eletroquímica pode estar presente em nosso dia a dia:
Além disso, a eletroquímica está presente em diversas aplicações na indústria química.
Agora, você já pode partir para o próximo tema de química no Enem!
Não esqueça de praticar alguns exercícios, aprender como ler a tabela periódica e reler nosso resumo de eletroquímica quando estiver mais próximo do exame.
Assim, o assunto estará fresco na sua mente e você estará mais preparado para responder às questões do Enem.
Por Redação Blog do EAD
Gostou deste conteúdo? Compartilhe com seus amigos!

2025 © BLOG DO EAD | Todos os Direitos Reservados
Explore carreiras, mercado de trabalho e cursos de graduação no Blog do EAD. Descubra oportunidades de aprendizado e dicas para seu desenvolvimento pessoal e profissional.
2024 © BLOG DO EAD | Todos os Direitos Reservados